CALOR - ENERGIA TÉRMICA EM
TRÂNSITO
Do mesmo modo que a
temperatura, a noção de calor é intuitiva.
Ela provém do contato diário
que temos com fontes de calor, como o fogo, uma
lâmpada de incandescente (filamento), ou o Sol.
Quando nós nos expomos ao
Sol, estamos nos aquecendo. Por outro lado,
quando colocamos a mão num pedaço de gelo, a
energia sai da mão para o gelo, que esta mais
frio. O sentido espontâneo de transferência de
energia sempre é do corpo de maior para o de
menor temperatura (energia). A energia
transferida de um corpo de maior para um de
menor temperatura é que denominamos calor.
A energia interna é a soma
de todas as energia no interior de uma
substância. Além da energia cinética
vibracional, existe a energia
translacional, energia cinética rotacional e energia
potencial.
UNIDADE DE CALOR
Sendo o calor (Q) uma forma
de energia, temos:
unid (Q)CGS = erg
unid (Q)SI =
joule (J)
Caloria (cal) = quantidade
de calor necessária para aumentar, de 1º C, a
temperatura da massa 1 g de água sob pressão de
1 atm.
1 cal = 4,18 J
MÉTODOS DE TRANSFERÊNCIA DE
CALOR
1. Condução: na
transferência de calor característica de corpos
sólidos, as
moléculas vibram, permitindo a propagação da
energia, mas mantém uma mesma posição média.

2. Convecção: a
transferência de calor característica dos
fluidos, se faz com
transporte de matéria: são massas aquecidas que
se transferem de uma região para outra.

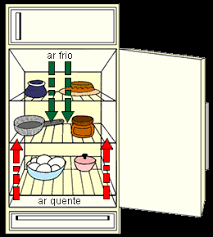
3. Radiação: a transferência
de calor se faz sem qualquer interferência de
matéria. Desse modo, a energia, sob forma de
radiação eletromagnética, pode propagar-se no vácuo. O
calor do Sol chega até a Terra por esse
processo.

CAPACIDADE TÉRMICA DE UM
CORPO
Sabemos que um corpo, em
estado físico definido, ao receber ou ceder
calor, apresenta variações de temperatura.
O quociente entre o calor
absorvido ou cedido por um corpo e a
correspondente variação de temperatura é denominada
capacidade térmica.
unidade (C)
sendo C = Q/Dt
unidade C = cal/ºC
CALOR ESPECÍFICO DE UMA
SUBSTÂNCIA
É a energia necessária para
que 1g de uma substância varie em 1ºC sua
temperatura. Pode dizer-se também que é a
capacidade térmica por unidade de massa c = C/m.
c = Q/Dt.
m-¹
unidade (c) c = cal/
g.ºC = 1 Btu/lb.ºF = 4186,8 J/kg.K
Calor específico de algumas
substâncias (c)
|
Substâncias |
cal/ g.ºC |
J/kg.K |
|
Água |
1,00 |
4187 |
|
Alumínio |
0,22 |
900 |
|
Areia |
0,20 |
840 |
|
Carbono |
0,12 |
|
|
Cobre |
0,093 |
386 |
|
Chumbo |
0,031 |
128 |
|
Estanho |
0,055 |
|
|
Ferro |
0,11 |
|
|
Gelo |
0,55 |
2220 |
|
Latão |
0,094 |
380 |
|
Mercúrio |
0,033 |
140 |
|
prata |
0,056 |
236 |
|
Vapor
(água) |
0,48 |
|
|
vidro |
0,20 |
840 |
| |
|
|
Calor Sensível e
Calor Latente
A experiência
mostra que a troca de calor entre sistemas a
diferentes temperaturas, postos em presença,
pode ter as seguintes consequências:
1- O sistema que
recebe (cede ) calor mantém seu estado de
agregação acusando porém uma variação de
temperatura. Neste caso o calor trocado é dito
sensível.
Q = m.c.Dt
2- O sistema que
recebe(cede) calor não acusando variação de
temperatura porém apresentando mudança de estado
de agregação. Neste caso o calor trocado pelo
sistema com o exterior é dito latente.
Q = m.L
Exemplos:
1- Ao absorver 600
cal, a temperatura de 30g de determinada
substância passou 20ºC para 60ºC. Determinar:
a) a capacidade
térmica do copo;
Resp: 15 cal/ºC
b) o calor
específico da substância.
Resp: 0,50 cal/gºC
2- Determinar que
temperatura alcançam 500g de ferro, inicialmente
a 20,0 ºC, quando absorvem 1200 cal.
Resp: tf = 41,8ºC
3- Calcular a
quantidade de calor cedida por 80g de alumínio,
quando a temperatura passa de 80ºC para 20ºC.
Resp: Q = - 1056 cal.
4- Um corpo de
alumínio tem massa de 400g e está a 20ºC.
Sabendo-se que recebeu 1200 cal, calcular:
a) a sua
capacidade térmica;
Resp: 88 cal/ºC.
b) a temperatura
que alcança. Resp: 33,6ºC.
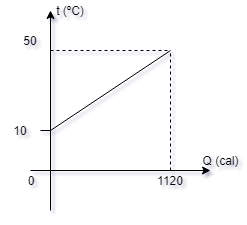
5- O gráfico
mostra o comportamento de 68g de terminada
substância ao serem aquecidos. Calcular.
a) a capacidade
térmica; Resp:
28 cal/ºC
b) o calor
específico. Resp:
0,41 cal/ g ºC
6- Determinar o
calor cedido a 800g de água, que se resfriam de
90ºC até 20ºC. Resp: 5,6x
104 cal.
TROCAS DE CALOR
Sabemos que, quando dois ou
mais corpos de temperaturas diferentes são
colocados em contato, formando um sistema
isolado, há troca de calor entre eles, até que
todo o sistema alcance a temperatura de
equilíbrio.
Sendo o sistema isolado ,
ele é conservativo ( a energia se conserva), e
podemos aplicar o princípio da conservação da
energia, escrevendo a equação fundamental da
calorimetria.
calor cedido =
calor recebido ou também expresso
SQ
= zero.
Exemplos:
1- Um recipiente
de alumínio, de massa 100g, contém 600g de água,
a 20ºC. Neste recipiente, são colocados 800g de
ferro, 140ºC. Calcular a temperatura de
equilíbrio. Resp.: 34,9ºC.
2- Um recipiente
adiabático contém 400g de água, a 10ºC. Calcular
a massa de ferro, a 134ºC, que devemos adicionar
ao conjunto, para que a temperatura da alcance
25ºC. Resp.: 500g
3- Em um
recipiente de alumínio de 50g, existem 800g de
água, a 25ºC. Dentro do recipiente, são
colocadas mais 300g de água, a 10ºC, e 500g de
ferro, a 50ºC. Determinar a temperatura de
equilíbrio.
DADOS: cAl
= 0,22 cal/gºC
cFe = 0,11 cal/gºC
c água= 1,0 cal/gºC
Resp.: 22,3 ºC
4- Misturando 3 kg
de água, a 20ºC, com 7 kg de água, a 50ºC, qual
a temperatura de equilíbrio?
Resp.: 41ºC
Exercícios.
1- Um corpo de
massa 150kg tem capacidade térmica de 50 cal/g.
Sabendo-se que recebeu 4500 cal, determinar:
a) a variação de
sua temperatura;
Resp.: 90ºC
b) seu calor
específico.
Resp.: 0,33 cal/gºC
2- Um corpo de
ferro tem 250g de massa e está a uma temperatura
de 20ºC. Ele é, então, aquecido a uma taxa de
120 cal/min.
Calcular:
a) a temperatura
que atinge, em 5 minutos;
Resp.: 41,8ºC
b) o tempo que
gasta para alcançar 100ºC.
Resp.: 18,3 min
3- Determinar o
calor liberado quando 120g de vapor d'água
passam de 200ºC para 120ºC. Resp.: 4608 cal.
4- A mesma
quantidade de calor é fornecida a 100 de cobre e
a 100g de alumínio, ambos a 10ºC. O cobre atinge
100ºC. Determinar a temperatura atingida pelo
alumínio. Resp.: 48ºC
5- A temperatura
de três líquidos diferentes se mantém a 15ºC,
20ºC e 25ºC. Quando massa iguais dos dois
primeiros líquidos se misturam, a temperatura de
equilíbrio é de 18ºC. Quando massa iguais do
segundo e terceiro se misturam, a temperatura de
equilíbrio é de 24ºC. Que temperatura de
equilíbrio se obtém, quando se misturam massas
iguais de primeiro e do terceiro líquidos?
Resp.: d
a) 19,5 ºC
b) 20,4ºC
c) 22,0ºC
d) 23,6ºC
e) 24,2ºC
Teste
Assinale com V as
afirmações verdadeiras e com F as afirmações
falsas:
1-( ) Calor é uma
forma de energia que se atribui somente aos
corpos quentes.
2-( ) Quantidade
de calor e temperatura são grandezas diretamente
proporcionais.
3-( ) Calor e
temperatura são conceitos diferentes.
4-( ) A capacidade
calorífica de um corpo é a quantidade de calor
que ele pode armazenar numa dada temperatura.
5-( ) Quando o
sistema passa do estado i para o estado f o
calor fornecido é o mesmo, qualquer que seja a
transformação que leva o sistema de i a f.
6-( ) Cp é
maior que o Cv para todos os gases.
7-( ) O calor
específico é a capacidade térmica da unidade de
massa do sistema.
8-( ) O
equivalente em água de um corpo é igual ao
produto da massa do corpo pelo seu calor
específico.
9-( ) A grande
maioria dos elementos sólidos apresenta o mesmo
calor atômico.
10-( ) Aplica-se
ao caso do calor o princípio da conservação de
energia.
11-( ) O calor
específico depende do estado de agregação da
substância.
12-( ) As
variedades alotrópicas de uma substância
apresentam o mesmo calor específico.
GABARITO: 1F - 2F - 3V - 4F - 5F - 6V - 7V - 8V
- 9V - 10V - 11V - 12F.
Assinale com X a
alternativa correta.
1. Calor é:
a-( ) uma forma de
energia que se atribui aos corpos quentes.
b-( ) uma forma de
energia que não existe nos corpos frios.
c-( ) o mesmo que
temperatura de um corpo.
d-( ) energia em
trânsito de um corpo para outro, quando entre
eles há diferença de temperatura.
e-( ) nenhuma das
anteriores.
2-Quantidade de
calor e temperatura:
a-( ) são
grandezas de mesma natureza.
b-( ) são
proporcionais.
c-( ) são pouco
diferentes.
d-( ) são
inversamente proporcionais.
e-( ) são
conceitos diferentes.
3- Consideremos
dois corpos de substâncias diferentes, de mesma
massa e que recebam a mesma quantidade de calor.
A variação de temperatura é:
a-( ) maior no
corpo de menor calor específico.
b-( ) maior no
corpo de maior calor específico.
c-( ) maior no
corpo que tiver inicialmente temperatura menor.
4- A massa de água
existente na Terra é da ordem de 1018
toneladas. Se ocorresse um abaixamento de
temperatura da água de 10 C, o calor
liberado seria, em Kcal:
a-( ) 1024
b- ( ) 1018
c-( ) 1021
d-( ) 4,18 x
1021
e-( )4,18 x 1018
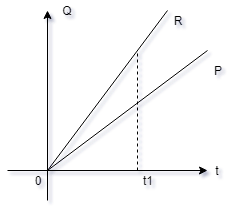
5- O gráfico
mostra a variação da quantidade de calor
absorvida por dois corpos P e R, que possuem
massas iguais em função da temperatura.
Conclui-se que, à temperatura t1:
a-( ) as
capacidades térmicas de P e R são iguais.
b-( ) o calor
específico de P é maior que o de R.
c-( ) a capacidade
térmica de P é menor do que a de R.
d-( ) o calor
específico de P pode ser igual ao de R.
e-( ) todas as
afirmações feitas são possíveis.
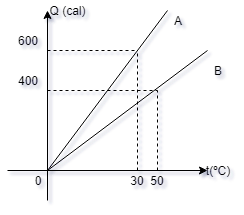
6- O diagrama
representa a quantidade de calor absorvida por
dois corpos A e B, de massas iguais, em função
da temperatura. A relação entre os calores
específicos dos corpos A e B é:
a-( ) 2/3
b-( ) 3/4
c-( ) 2/1
d-( ) 5/1
e-( ) 5/2
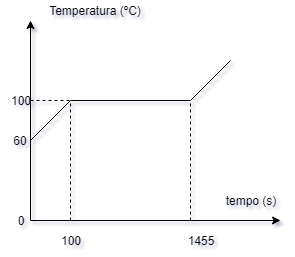
7- Uma fonte
calorífica fornece calor com potência constante,
a 500 gramas de água (calor específico igual a 1
cal.g-1. C-1) sob pressão
normal. A temperatura da água varia de acordo
com o gráfico abaixo, o qual não está desenhado
em escala. Nessas condições, o calor latente de
vaporização da água é:
a-( ) -540 cal.g-1
b-( ) 539 cal.g-1
c-( ) 540 cal.g-1
d-( ) 541 cal.g-1
e-( ) 542 cal.g-1
O gráfico da
quantidade de calor absorvida por um corpo de
massa 5 gramas, inicialmente líquido, em
função da temperatura t, em uma transformação
sofrida por esse corpo, é dado pela figura
abaixo.
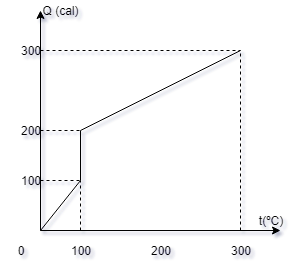
Este gráfico
refere-se às questões 8 e 9.
8- O calor latente
da mudança de fase ocorrida vale:
a-( ) 100 cal/g
b-( ) 20 cal/g
c-( ) 200 cal/g
d- ( ) 40 cal/g
e-( ) nenhuma das
anteriores.
9- O calor
específico da substância no estado líquido vale:
a-( ) 1 cal/g0C
b-( ) 0,1 cal/g0C
c-( ) 0,25 cal/g0C
d- ( ) 0,2 cal/g0C
e- ( ) nenhuma das
anteriores
10- Se num sistema
termicamente isolado e constituído pelos corpos
A, B e C ocorre, ao fim de um lapso de tempo, a
elevação das temperaturas de A e de B, podemos
concluir que o corpo C:
a-( ) perdeu calor
em quantidade igual ao ganho por A
b-( ) ganhou calor
em quantidade determinada
c-( ) não ganhou
nem perdeu calor
d-( ) ganhou
calor, mas não se pode dizer em que quantidade
e-( ) perdeu
calor, mas sua temperatura pode não ter
diminuído.
11- Misturam-se,
em um calorímetro, 100g de água, a 200C,
e 300 g de água a 400C. A temperatura
de equilíbrio da mistura é:
a-( ) 350C
b-( ) 300C
c-( ) 600C
d-( ) 200C
e-( ) 320C
12- Um bloco
metálico A encontra-se inicialmente à
temperatura t0C. Sendo colocado em
contato com outro bloco B de material diferente,
mas de mesma massa, inicialmente a 00C,
verifica-se no equilíbrio térmico que a
temperatura dos dois blocos é de 0,75t0C.
Supondo que só houve troca de calor entre os
dois corpos, a relação entre os calores
específicos dos materiais é:
a-( ) cA/cB=
1/4
b-( ) cA/cB=
4
c-( ) cA/cB=
0,4
d-( ) cA/cB=
40
e-( ) cA/cB=
3
13- A temperatura
de um corpo de 200g passou de 200C
para 300C
quando esse
recebeu 500 cal. O calor específico do corpo é:
a-( ) 2,5 cal/g.0C
b-( ) 0,25 cal/g.0C
c-( ) 5,0 cal/g.0C
d-( ) 50 cal/g.0C
e-( ) 500 cal/g.0C
14- Selecione
abaixo a alternativa que supre as omissões nas
frases seguintes:
Para fazer a
temperatura de um corpo sólido passar de 00C
para 1000C foram fornecidos a ele 20
cal.
Se a massa do
corpo é de 50 gramas, podemos concluir que .....
é de ...........
a-( ) o calor de
fusão; 0,2 cal/0C
b-( ) a
produtividade; 0,004 cal/g0C
c-( ) a capacidade
térmica; 0,4 cal/g
d-( ) o calor
específico; 0,004 cal/g0C
e-( ) o calor
latente; 40 cal0C/g
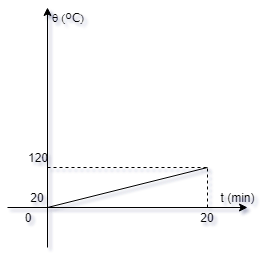
15-O gráfico
abaixo dá a temperatura
q
em função do tempo t, de um corpo que recebe
calor de uma fonte à razão de 1000 cal/min, e
não cede calor. A capacidade térmica do corpo,
em cal/0C é:
a-( ) 2
b-( ) 14,3
c-( ) 20
d-( ) 143
e-( ) 200
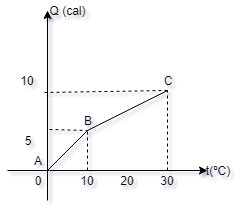
16- Um corpo de
massa = 1g está à temperatura de 00C.
Sendo-lhe fornecida a quantidade de calor Q, sua
temperatura eleva-se à temperatura t, conforme
mostra o gráfico. Duas regiões são distintas, AB
e BC. Considerando o gráfico, quais são os
calores específicos da substância de que é feito
o corpo, nessas duas regiões , AB e BC,
respectivamente, em cal/0C.g:
a-( ) 0,25; 0,50
b-( ) 0,35; 0,35
c-( ) 0,50; 0,25
d-( ) 0,75; 0,15
e-( ) 1,00; 0,10
17- A tabela
abaixo apresenta a massa m de cinco objetos de
metal, com seus respectivos calores específicos
c.
| Metal |
c
(cal/gºC) |
m (g) |
C(m.c)
cal/ºC |
|
Alumínio |
0,217 |
100 |
21,7 |
| Ferro |
0,113 |
200 |
22,6 |
| Cobre |
0,093 |
300 |
27,9 |
| Prata |
0,056 |
400 |
22,4 |
| Chumbo |
0,031 |
500 |
15,5 |
Objeto que tem
maior capacidade térmica é o de:
a-( ) alumínio
b-( ) ferro
c-( ) chumbo
d-( ) prata
e-( ) cobre
18- Considere as
afirmativas:
I- O calor
absorvido ou cedido por um corpo depende, além
da temperatura, da massa e da natureza da
substância que constitui o corpo.
II- Capacidade
térmica de um corpo é a razão entre a quantidade
de calor a ele cedida e a variação da
temperatura correspondente.
III- Um corpo pode
receber calor sem aumentar a sua temperatura.
Assinale:
a-( ) somente a I
é correta
b-( ) somente a II
é correta
c-( )somente II e
III são corretas
d-( ) todas são
corretas
e-( ) nenhuma é
correta
19- Com o objetivo
de determinar o calor específico de um pequeno
cilindro de alumínio, um aluno despeja 200g de
água quente num calorímetro onde, a seguir,
coloca o cilindro de alumínio. Ele usa um
termômetro para medir a temperatura inicial da
água (tia) e a temperatura final de
equilíbrio (tf). Considere que o
calorímetro não absorve calor, isto é, que
somente há trocas de calor entre a água e o
alumínio. Qual dos dados I, II e III abaixo
relacionados o aluno ainda necessita para
determinar o calor específico do alumínio?
I- temperatura
inicial do alumínio
II- massa do
cilindro de alumínio
III- calor
específico da água
a_( ) apenas I
b-( ) apenas I e
II
c_-( ) apenas I e
III
d-( ) apenas II e
III
e-( ) I, II e III
20- A quantidade
de calor que se deve fornecer a 1Kg de uma
substância para elevar sua temperatura de 50C
é igual a 3.000 cal. O calor específico da
substância, no intervalo de temperatura
considerado, é dado, em cal/g0C, por:
a-( ) 0,6
b-( ) 15
c-( ) 3
d-( ) 2,7
e-( ) nenhuma das
anteriores
GABARITO: 1D - 2C -3A - 4C - 5C - 6E - 7E -8B -
9C - 10E - 11A - 12E - 13B - 14D - 15E - 16C -
17E - 18D - 19E - 20A
21- 60 g de um líquido a 100 C
são misturados com 40 g do mesmo líquido à
temperatura de 500 C. Qual será a temperatura
final da mistura?
a- ( ) 700 C
b- ( ) 300 C
c- ( ) 400 C
d- ( ) não podemos calcular a
temperatura final por insuficiência de dados
e- ( ) n.d.a.
22- Dois corpos A e B, à mesma
temperatura, são colocados em contato. Sabe-se
que o calor específico do corpo A é três vezes
maior que o do corpo B. Assinale a afirmação
correta:
a- ( ) o calor fui do corpo A
para o corpo B
b- ( ) o calor flui do corpo B
para o corpo A
c- ( ) não há fluxo de calor
entre os dois corpos
d- ( ) a quantidade de valor
contida no corpo A é três vezes maior
e- ( ) os dois corpos contém a
mesma quantidade de calor
23- Admitindo que o calor
específico da água é constante, assinale a
afirmação verdadeira:
a- ( ) a quantidade de calor
necessária para duplicar a temperatura da mesma
massa de água é tanto maior quanto menor for a
temperatura inicial
b- ( ) a quantidade de calor
necessária para obter a mesma elevação de
temperatura é inversamente proporcional à massa
da água
c- ( ) a quantidade de calor
necessária para aquecer uma massa de água de 100
C a 400 C é a mesma que para aquecê-la de 400 C
a 800 C
d- ( ) o calor dissipado por 100
g de água no resfriamento de 400 C a 100 C é o
mesmo que deve ser fornecido para a mesma massa
de água ser aquecida de 300 C a 600 C
e- ( ) n.d.a.
Um corpo absorve calor de uma
fonte à razão de 1000 cal/min. O gráfico da
temperatura q, em função do tempo t, está
indicado a seguir:
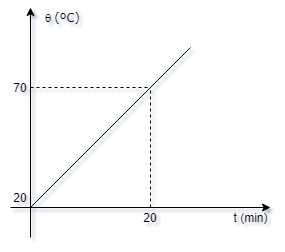
24- A capacidade térmica do corpo
em cal/0 C é:
a- ( ) 286
b- ( ) 300
c- ( ) 1000
d- ( ) 800
e- ( ) n.d.a.
25- Se a massa do corpo aquecido
é 100 g, o calor específico do corpo, em cal/0
C, é:
a- ( ) 0,2
b- ( ) 0,3
c- ( ) 0,5
d- ( ) 0,1
e- ( ) n.d.a.
No gráfico abaixo, estão
representadas as variações com o tempo das
temperaturas de dois corpos homogêneos,
inicialmente sólidos, de substâncias diferentes
e massas iguais. Sabe-se que esses corpos
receberam calor em quantidades iguais por
unidade de tempo.
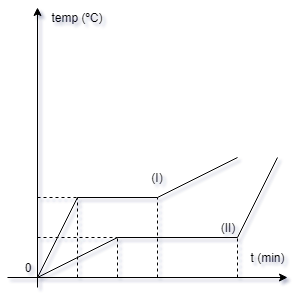
Este texto e figura referem-se às
questões de números 26 e 27.
26- Qual dos valores abaixo
representa melhor a relação cI/cII dos calores
específicos dessas substâncias, enquanto no
estado sólido?
a- ( ) 1/10
b- ( ) 1/4
c- ( ) 2/5
d- ( ) 1
e- ( ) 4
27- Qual dos valores abaixo
representa a relação LI/LII dos calores latentes
de fusão dessas substâncias?
a- ( ) 1/4
b- ( ) 1/2
c- ( ) 1
d- ( ) 2
e- ( ) 4
28- O calor latente de
vaporização da água a 1000 C é 540 cal/g.
Suponha que temos 1 g de água líquida a 1000 C.
A partir de um certo instante, 100 cal são
cedidas àquela massa de água, sendo mantida
constante a pressão. A temperatura da água:
a- ( ) dobrará
b- ( ) diminuirá
c- ( )triplicará
d- ( ) permanece a mesma
e- ( ) n.d.a.
29- A quantidade de calor
necessária, em média, para elevar de um grau
Celsius a temperatura de um grama de uma
substância, recebe o nome de:
a- ( ) capacidade térmica
b- ( ) equivalente térmico
c- ( ) calor de fusão
d- ( ) calor latente
e- ( ) calor específico
30- Três esferas maciças de
ferro, de mesmo tamanho, são colocadas em um
calorímetro ideal. Inicialmente, as temperaturas
destes corpos são, respectivamente 200 C, 400 C
e 600 C. Qual será a temperatura dos corpos
quando o sistema entrar em equilíbrio térmico?
a- ( ) 200 C
b- ( ) 300 C
c- ( ) 400 C
d- ( ) 500 C
e- ( ) 600 C
GABARITO:
21E;22C;23D;24E;25E;26B;27B;28D;29E;30C.